透析溶液中离子浓度大小的比较
11-01 12:05:13 | 浏览次数: 57718 次 | 栏目:高考化学复习方法
标签:高考化学复习方法,http://www.manfen6.com
透析溶液中离子浓度大小的比较,
)c(HA) (2)混合溶液中c(HA)+c(A-)0.1 mol/L (3)混合溶液中,由水电离出的c(OH-)0.2 mol/LHA溶液中由水电离出的c(H+) (4) 25℃时,如果取0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的PH<7,则HA的电离程度NaA的水解程度。 解析 (1)将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,溶质为等物质的量的HA和NaA,已知c(Na+)>c(A-),由电荷守恒可知c(OH-)>c(H+)溶液呈碱性,说明HA是弱酸且电离程度小于A-的水解程度,使得c(A-)<c(HA)。 (2)由物料守恒和等体积混合后溶液浓度减半可知:c(HA)+c(A-)=0.1mol/L (3)混合溶液中由于NaA的存在,水解会促进水的电离,而0.2 mol/L HA溶液中水的电离受到抑制,因此前者大。 (4)由(1)分析可知pH<7溶液呈酸性,说明HA电离程度大于A-的水解程度。 答案(1)< (2)= (3)> (4)> 针对性训练:用0.1 mol?.L-1的盐酸滴定0.10 mol?.L-1的氨水,滴定过程中不可能出现的结果是( ) A.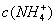 >
>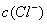 ,
,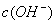 >
>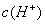 B.
B. 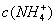 =
=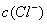 ,
,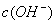 =
=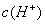 C.
C.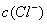 >
>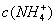 ,
,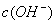 >
>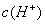 D.
D. 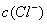 >
>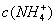 ,
,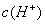 >
>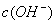 解析 据电荷守恒,在滴定过程中存在c(NH4+)+ c(H+)= c(Cl-)+c(OH-),因此不可能出现阴离子浓度都大于阳离子浓度的情况,其他情况可从往氨水中逐滴加入同浓度的盐酸后溶液中离子浓度大小关系动态分析得出。
(1)加入少量的盐酸时,溶液中溶质为NH4Cl和NH3·H2O,且c(NH3·H2O)>c(NH4Cl),NH3
www.manfen6.com
·H2O的电离占绝对优势,NH4Cl的水解受到抑制,溶液的PH>7显碱性,此时溶液中离子浓度关系为:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
(2)随着盐酸的不断加入,溶液中溶质仍为NH4Cl和NH3·H2O,溶液中c(Cl-)会逐渐大于c(OH-),溶液的pH>7显碱性,此时溶液中离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(3)当盐酸加入一定程度时,溶质仍为NH4Cl和NH3·H2O,溶液呈中性。此时溶液中离子浓度关系为:
c(NH4+)= c(Cl-)>c(OH-)=c(H+);
(4)加入盐酸的物质的量等于NH3·H2O的物质的量时,溶质为NH4Cl,溶液呈酸性,此时溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)如再加入少量的盐酸,溶质为NH4Cl和HCl,且c(NH4Cl)>c(HCl)溶液呈酸性,此时溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(6)如果再加入大量的盐酸,溶质仍为NH4Cl和HCl,且c(HCl)>c(NH4Cl)溶液呈酸性,此时溶液中离子浓度关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-)。
因此答案为 C。
TAG:
解析 据电荷守恒,在滴定过程中存在c(NH4+)+ c(H+)= c(Cl-)+c(OH-),因此不可能出现阴离子浓度都大于阳离子浓度的情况,其他情况可从往氨水中逐滴加入同浓度的盐酸后溶液中离子浓度大小关系动态分析得出。
(1)加入少量的盐酸时,溶液中溶质为NH4Cl和NH3·H2O,且c(NH3·H2O)>c(NH4Cl),NH3
www.manfen6.com
·H2O的电离占绝对优势,NH4Cl的水解受到抑制,溶液的PH>7显碱性,此时溶液中离子浓度关系为:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
(2)随着盐酸的不断加入,溶液中溶质仍为NH4Cl和NH3·H2O,溶液中c(Cl-)会逐渐大于c(OH-),溶液的pH>7显碱性,此时溶液中离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(3)当盐酸加入一定程度时,溶质仍为NH4Cl和NH3·H2O,溶液呈中性。此时溶液中离子浓度关系为:
c(NH4+)= c(Cl-)>c(OH-)=c(H+);
(4)加入盐酸的物质的量等于NH3·H2O的物质的量时,溶质为NH4Cl,溶液呈酸性,此时溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)如再加入少量的盐酸,溶质为NH4Cl和HCl,且c(NH4Cl)>c(HCl)溶液呈酸性,此时溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(6)如果再加入大量的盐酸,溶质仍为NH4Cl和HCl,且c(HCl)>c(NH4Cl)溶液呈酸性,此时溶液中离子浓度关系为:c(Cl-)>c(H+)>c(NH4+)>c(OH-)。
因此答案为 C。
TAG:
)c(HA) (2)混合溶液中c(HA)+c(A-)0.1 mol/L (3)混合溶液中,由水电离出的c(OH-)0.2 mol/LHA溶液中由水电离出的c(H+) (4) 25℃时,如果取0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,测得混合溶液的PH<7,则HA的电离程度NaA的水解程度。 解析 (1)将0.2 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合,溶质为等物质的量的HA和NaA,已知c(Na+)>c(A-),由电荷守恒可知c(OH-)>c(H+)溶液呈碱性,说明HA是弱酸且电离程度小于A-的水解程度,使得c(A-)<c(HA)。 (2)由物料守恒和等体积混合后溶液浓度减半可知:c(HA)+c(A-)=0.1mol/L (3)混合溶液中由于NaA的存在,水解会促进水的电离,而0.2 mol/L HA溶液中水的电离受到抑制,因此前者大。 (4)由(1)分析可知pH<7溶液呈酸性,说明HA电离程度大于A-的水解程度。 答案(1)< (2)= (3)> (4)> 针对性训练:用0.1 mol?.L-1的盐酸滴定0.10 mol?.L-1的氨水,滴定过程中不可能出现的结果是( ) A.
- ·上一篇:超温馨的爱情语录:有你的日子,好实在!
- ·下一篇:如何进行物理阅读
《透析溶液中离子浓度大小的比较》相关文章
- › 透析溶液中离子浓度大小的比较
- 在百度中搜索相关文章:透析溶液中离子浓度大小的比较
最新更新
- · 透析溶液中离子浓度大小的比较
- · 可逆反应达到平衡状态的标志及判断
- · 高中化学复习从自身做起
- · 推断题中的直线形转化归纳及应用
- · 新学期高中化学学习方法指导
- · 高中化学学习方法指导
- · 高中化学学习方法浅谈
- · 高考状元笔记:化学离不开记忆
- · 如何听好化学课
- · 夯实基础的高考化学复习方法
- · 高中化学学习要诀
- · 高中化学,化学反应速度知识点
- · 高中化学的学习
- · 化学课本空白栏的有效利用
- · 高中化学学习方法
- · 高中化学口诀完全版-另付解释
热门排行